諾貝爾醫(yī)學(xué)獎(jiǎng)揭曉
2018-10-02 20:08?出處 綜合
諾貝爾醫(yī)學(xué)獎(jiǎng)揭曉:2018年10月1日,2018諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)重磅揭曉,免疫療法先驅(qū)James P.Allison教授與Tasuku Honjo教授獲獎(jiǎng),表彰兩位科學(xué)家在癌癥免疫治療領(lǐng)域的奠定性工作。

獲獎(jiǎng)?wù)撸篔ames P.Allison和Tasuku Honjo,獲獎(jiǎng)原因:發(fā)現(xiàn)免疫檢查點(diǎn)抑制癌癥療法
這兩位令人尊敬的醫(yī)學(xué)家在癌癥免疫治療領(lǐng)域取得了了不起的創(chuàng)新性成果,徹底改變了人類(lèi)對(duì)抗癌癥的格局。當(dāng)下,可以負(fù)責(zé)任的說(shuō),免疫療法或許會(huì)成為人類(lèi)癌癥治療的新希望。
James P.Allison教授是癌癥免疫療法的先驅(qū)之一,也被稱(chēng)“CTLA-4抗體Yervoy之父”。作為現(xiàn)代腫瘤免疫治療的奠基人之一,在研究T細(xì)胞反應(yīng)的調(diào)節(jié)和癌癥免疫治療策略有著杰出貢獻(xiàn),確定了T細(xì)胞受體結(jié)構(gòu),證實(shí)CTLA-4通過(guò)對(duì)抗 CD28介導(dǎo)的共同刺激抑制T細(xì)胞活化。
Tasuku Honjo教授是來(lái)自日本的醫(yī)學(xué)家、美國(guó)國(guó)家科學(xué)院外籍院士。1992年,Tasuku Honjo發(fā)現(xiàn)T細(xì)胞抑制受體PD-1,2013年依此開(kāi)創(chuàng)了癌癥免疫療法,功績(jī)名列《Science》年度十大科學(xué)突破之首。Tasuku Honjo是德國(guó)醫(yī)學(xué)最高獎(jiǎng)羅伯·柯霍獎(jiǎng)的“科霍獎(jiǎng)”得主。
抗癌的心路歷程
19世紀(jì)末,美籍醫(yī)生Coley意外的發(fā)現(xiàn),手術(shù)后感染釀膿鏈球菌病人的癌癥出現(xiàn)了緩解跡象,第一次打開(kāi)了免疫療法治療癌癥的大門(mén)。
20世紀(jì)60年代,澳籍免疫學(xué)家Burnet提出的“免疫監(jiān)視理論”。
盡管免疫療法治療癌癥在理論上被實(shí)現(xiàn),但如何激活T細(xì)胞(可以理解為攻擊細(xì)菌/癌細(xì)胞的“大炮”)來(lái)對(duì)抗癌癥,成為科學(xué)家們關(guān)注的一個(gè)重要的難題。
1987年,法國(guó)醫(yī)學(xué)家科學(xué)團(tuán)隊(duì)發(fā)現(xiàn)了T細(xì)胞上的一個(gè)跨膜受體CTLA 4。
1992年,京都大學(xué)免疫學(xué)家Tasuku Honjo 本庶佑教授發(fā)現(xiàn)了另外一位于T細(xì)胞上的重要免疫抑制受體分子PD 1(programmed death 1)。然而,真正將PD 1和免疫聯(lián)系起來(lái)已是7年后了,這要?dú)w功于耶魯大學(xué)陳列平教授了。他們發(fā)現(xiàn)腫瘤細(xì)胞表面的配體分子PD L1會(huì)通過(guò)和PD 1相結(jié)合,從而抑制T細(xì)胞激活從而發(fā)揮作用,這對(duì)于后面使用PD 1免疫療法治療癌癥,提供了重要的實(shí)驗(yàn)基礎(chǔ)。

1996年,Jim Allison在小鼠實(shí)驗(yàn)中首次發(fā)現(xiàn),CTLA 4扮演的就是“剎車(chē)”的角色,抑制CTLA 4能夠激活T細(xì)胞持續(xù)的對(duì)癌癥進(jìn)行攻擊。
通過(guò)不斷的人體研究,CTLA-4抗體始終表現(xiàn)出色,為廣大癌癥患者帶去了希望。
2011年,CTLA-4抗體制成的藥物ipilimumab (Yervoy)經(jīng)過(guò)FDA批準(zhǔn)上市,用來(lái)治療轉(zhuǎn)移性黑色素瘤,這是免疫療法的一次里程碑式的勝利。
《科學(xué)》雜志將腫瘤免疫治療列為2013 年十大科學(xué)突破的首位,免疫治療有望成為繼手術(shù)、化療、放療、腫瘤靶向治療后的新一代的腫瘤治療手段。腫瘤免疫治療包括免疫檢查點(diǎn)抑制劑(抗PD-1 單抗等)、治療性疫苗、CAR-T 細(xì)胞治療等。
2014年,PD 1抗體Pembrolizumab(Keytruda)通過(guò)FDA批準(zhǔn)上市,除了在黑色素瘤上的出色表現(xiàn),也其他實(shí)體瘤的治療效果,讓眾多的科學(xué)家們看到了治愈癌癥的希望。
2015年《新英格蘭醫(yī)學(xué)雜志》報(bào)道了一位49歲的黑色素瘤患者在CTLA 4抗體和PD 1抗體的聯(lián)合使用3周后,轉(zhuǎn)移瘤出現(xiàn)消失。這不僅僅大大增強(qiáng)了科學(xué)家們通過(guò)免疫療法戰(zhàn)勝癌癥的信心,也表明CTLA 4和PD 1通過(guò)協(xié)同作用,聯(lián)合抗癌。
2017年,美國(guó)賓夕法尼亞大學(xué)基于CAR-T療法提出的CTL019通過(guò)FDA批準(zhǔn)上市。

國(guó)內(nèi)單抗市場(chǎng)
PD-1 單抗已經(jīng)成為抗腫瘤藥市場(chǎng)的超級(jí)明星,也是腫瘤免疫療法中的一顆閃耀新星!Opdivo 和Keytruda 自2014年上市以來(lái),僅3個(gè)完整年度,2017年合計(jì)銷(xiāo)售額已達(dá)87.57 億美元。根據(jù)Evaluate Pharma 預(yù)測(cè),2022 年,Opdivo 和Keytruda 合計(jì)收入有望超過(guò)194 億美元,2017-2022 復(fù)合增長(zhǎng)率高達(dá)17%,是市場(chǎng)潛力最大的抗腫瘤靶向藥。
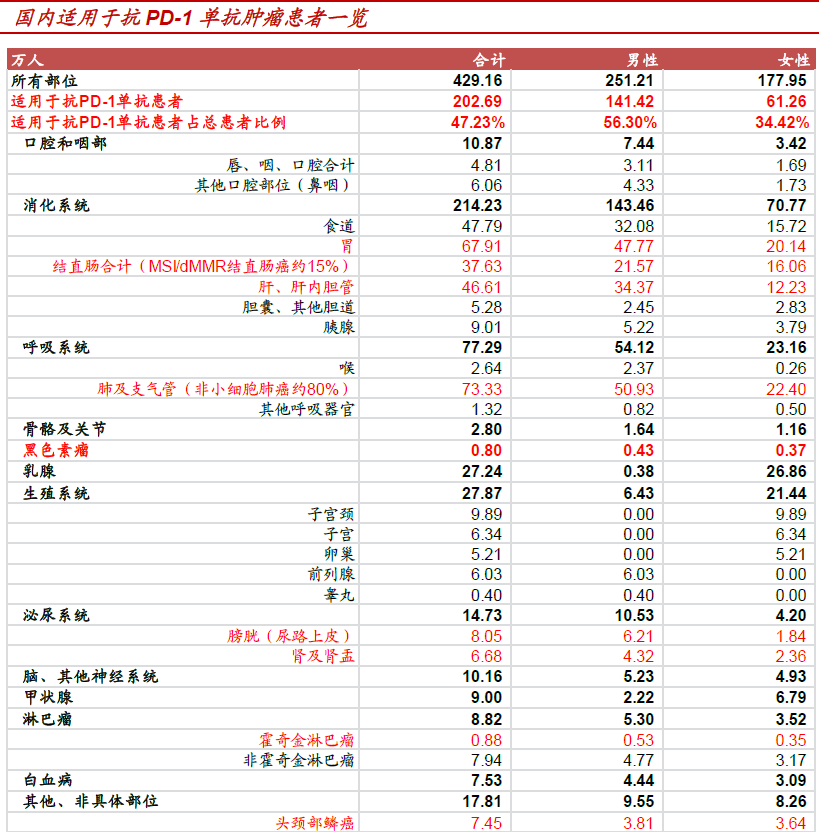
我國(guó)腫瘤年新增患者約429.16 萬(wàn)人,其中約202.69 萬(wàn)人可以適用于抗PD-1 單抗,約占總發(fā)病人數(shù)的47.23%。根據(jù)CA CANCER J CLIN 最新流行病學(xué)研究,我國(guó)每年新增腫瘤患者數(shù)量約429.16 萬(wàn)人。根據(jù)目前全球上市兩款抗PD-1 單抗藥已獲批適應(yīng)癥分析,我國(guó)每年新增腫瘤患者中約202.69 萬(wàn)人適用于抗PD-1 單抗(紅色),占總發(fā)病人數(shù)的47.23%。未來(lái),隨著抗PD-1 單抗以及聯(lián)合用藥的不斷開(kāi)發(fā),更多的新適應(yīng)癥有望陸續(xù)獲批,適用患者有望進(jìn)一步增加。
2018年是國(guó)內(nèi)抗PD-1 單抗上市元年,國(guó)產(chǎn)產(chǎn)品和進(jìn)口產(chǎn)品上市時(shí)間差距不大,國(guó)內(nèi)企業(yè)有望占據(jù)主要市場(chǎng)!國(guó)內(nèi)目前進(jìn)度最快的抗PD-1 單抗是百時(shí)美施貴寶的Opdivo,已于2017 年11 月2 日向CDE提交上市申請(qǐng),并進(jìn)入優(yōu)先審評(píng),有望于2018 年獲批上市;默沙東的Keytruda 國(guó)內(nèi)上市申請(qǐng)也于2018 年2 月11 日獲得CFDA 受理。
國(guó)產(chǎn)品種中,君實(shí)生物抗PD-1 單抗上市申請(qǐng)于2018 年3 月獲得CFDA 受理,恒瑞醫(yī)藥、百濟(jì)神州、信達(dá)生物有望快速跟進(jìn)。根據(jù)臨床進(jìn)度和遞交上市申請(qǐng)時(shí)間,預(yù)計(jì)包括君實(shí)生物、恒瑞醫(yī)藥、百濟(jì)神州和信達(dá)生物在內(nèi)的國(guó)產(chǎn)抗PD-1 單抗和進(jìn)口品種僅相差4-6個(gè)月,未來(lái)獲批上市時(shí)間也將差距不大。
國(guó)內(nèi)在研PD-1單抗一覽
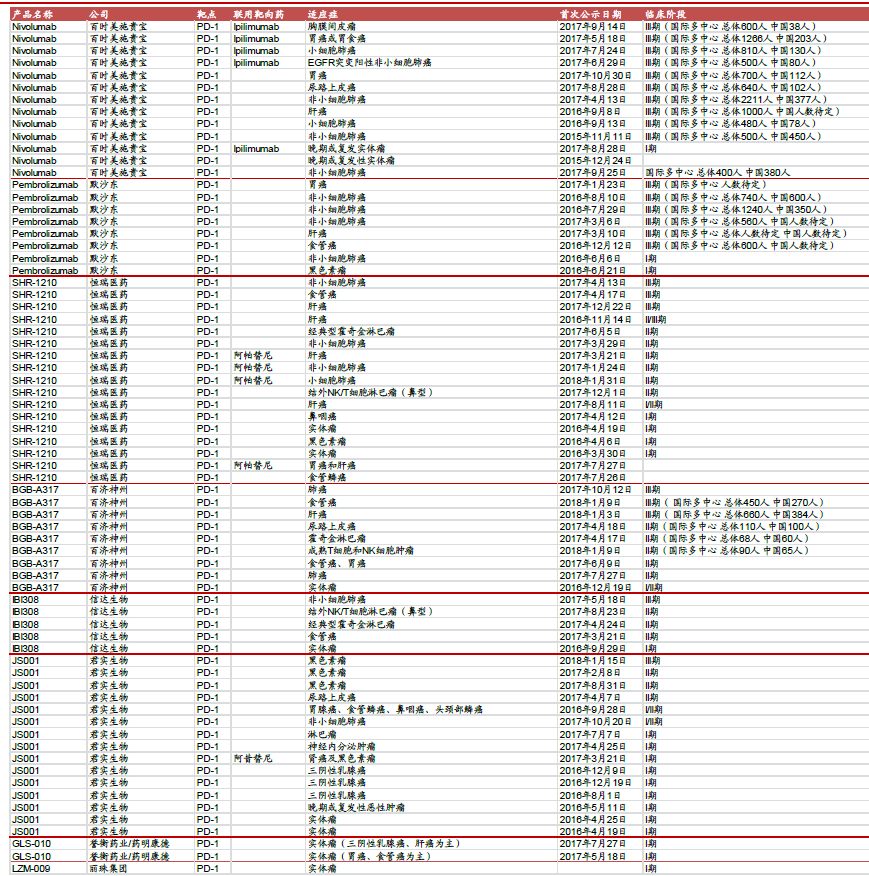
重點(diǎn)公司
恒瑞醫(yī)藥:重磅品種帶動(dòng)業(yè)績(jī)?cè)鏊偌涌欤蓢?guó)內(nèi)創(chuàng)新走向國(guó)際創(chuàng)新。 公司重磅創(chuàng)新藥吡咯替尼和抗PD-1 單抗有望于18年陸續(xù)獲批上市。
復(fù)星醫(yī)藥:是為數(shù)不多的同時(shí)擁有抗PD-1 單抗和抗PD-L1 單抗的企業(yè)。
百濟(jì)神州:抗PD-1 單抗開(kāi)展全球多中心III 期臨床,海外授權(quán)新基公司。公司抗PD-1 單抗海外授權(quán)新基,已經(jīng)啟動(dòng)肝癌和食管癌全球多中心III 期臨床試驗(yàn)和肺癌國(guó)內(nèi)III 期臨床試驗(yàn),是海外進(jìn)展最快的國(guó)產(chǎn)抗PD-1 單抗。
君實(shí)生物:公司抗PD-1 單抗JS001 上市申請(qǐng)獲得受理,并同時(shí)開(kāi)發(fā)多種適應(yīng)癥。公司布局眾多廣譜抗腫瘤品種,未來(lái)有望形成組合用藥。
麗珠集團(tuán):抗PD-1 單抗國(guó)內(nèi)外獲批臨床,加速向創(chuàng)新藥企業(yè)轉(zhuǎn)型。公司現(xiàn)金充裕,存在外延并購(gòu)預(yù)期,同時(shí)向創(chuàng)新藥企業(yè)轉(zhuǎn)型速度加速。
本文“”來(lái)源:http://www.f0574.cn/news/world/71458.html,轉(zhuǎn)載必須保留網(wǎng)址。作者:yujeu
諾貝爾獎(jiǎng) 相關(guān)文章
- 柬埔寨提名唐納德·特朗普角逐諾貝爾和平獎(jiǎng)
- 孟加拉國(guó)83歲入獄諾貝爾獎(jiǎng)獲得者你需要知道的一切
- 普京說(shuō) 諾貝爾和平獎(jiǎng)不是給記的盾牌
- 諾貝爾和平獎(jiǎng)獲得者批評(píng)臉書(shū)Facebook
- 諾貝爾和平獎(jiǎng)授予記者瑪麗亞·雷薩、德米特里·穆拉
- 2020年諾貝爾和平獎(jiǎng)揭曉
- 2020年諾貝爾文學(xué)獎(jiǎng)揭曉
- 特朗普被提名2021年諾貝爾和平獎(jiǎng)
- 諾貝爾醫(yī)學(xué)獎(jiǎng)揭曉 諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)揭曉
- 香港各界悼念高錕 諾貝爾獎(jiǎng)得主
- 本屆諾貝爾獎(jiǎng)停發(fā) 諾貝爾文學(xué)獎(jiǎng)停發(fā)
- 諾貝爾文學(xué)獎(jiǎng)丑聞
- 熱門(mén)內(nèi)容
- 網(wǎng)友熱議
- 精彩內(nèi)容
國(guó)際新聞一周熱點(diǎn)排行
- 1 美國(guó)查理·柯克謀殺案被捕嫌疑人已獲釋
- 2 以色列總理遭離場(chǎng)抗議 伊朗席位留一照片
- 3 美國(guó)駐華大使館:沒(méi)錢(qián)了 停更
- 4 美國(guó)一名“網(wǎng)紅”被殺 美國(guó)為何會(huì)降半旗
- 5 特朗普盟友查理·柯克遭槍擊身亡
- 6 美國(guó)聯(lián)邦工作人員清理馬斯克的狗狗幣殘骸
- 7 美國(guó)要求日本不要承認(rèn)巴勒斯坦
- 8 中方回應(yīng)巴勒斯坦申請(qǐng)加入金磚國(guó)家
- 9 美國(guó)發(fā)生斬首事件
- 10 曝烏總統(tǒng)每月轉(zhuǎn)5千萬(wàn)美元到沙特銀行

 美國(guó)聯(lián)邦工作人員清
美國(guó)聯(lián)邦工作人員清 猶他州槍擊案發(fā)生前
猶他州槍擊案發(fā)生前 尼泊爾將于3月5日舉行
尼泊爾將于3月5日舉行 特朗普向親密盟友查
特朗普向親密盟友查 英國(guó)小偷挑戰(zhàn)賽 參加
英國(guó)小偷挑戰(zhàn)賽 參加 石柏魁“撼”故宮 故
石柏魁“撼”故宮 故 拉里薩-里克爾梅Lar
拉里薩-里克爾梅Lar 克里米亞的前世今生
克里米亞的前世今生 阿麗娜·卡巴耶娃和普
阿麗娜·卡巴耶娃和普 釣魚(yú)島嶼最新事件中
釣魚(yú)島嶼最新事件中